Dalam dunia sains, khususnya kimia, istilah "larutan elektrolit" dan "larutan non elektrolit" sering muncul sebagai konsep dasar yang penting. Keduanya memiliki peran masing-masing dalam berbagai proses alami maupun teknologi modern. Namun, banyak orang masih bingung membedakan keduanya. Apa sebenarnya yang membedakan larutan elektrolit dari non elektrolit? Bagaimana cara mengidentifikasinya? Dan apa manfaat dari kedua jenis larutan ini dalam kehidupan sehari-hari?
Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik karena mengandung ion-ion bebas yang terbentuk dari senyawa-senyawa yang terionisasi. Sebaliknya, larutan non elektrolit tidak dapat menghantarkan arus listrik karena senyawanya tidak terionisasi. Dengan memahami perbedaan ini, kita bisa lebih mudah memahami bagaimana berbagai zat bekerja di lingkungan sekitar kita.
Tidak hanya itu, pemahaman tentang larutan elektrolit dan non elektrolit juga sangat penting dalam bidang kesehatan, industri, dan lingkungan. Misalnya, tubuh manusia membutuhkan elektrolit untuk menjaga keseimbangan cairan dan fungsi organ-organ vital. Sementara itu, non elektrolit seperti gula atau alkohol digunakan dalam berbagai aplikasi, mulai dari makanan hingga bahan bakar.
Artikel ini akan membahas secara lengkap mengenai perbedaan antara larutan elektrolit dan non elektrolit, termasuk pengertian, ciri-ciri, contoh, dan manfaatnya. Kami juga akan memberikan penjelasan yang jelas dan mudah dipahami agar pembaca dapat memahami konsep-konsep tersebut dengan baik.
Pengertian dan Ciri-Ciri Larutan Elektrolit dan Non Elektrolit
Sebelum memahami perbedaan antara larutan elektrolit dan non elektrolit, penting untuk memahami apa yang dimaksud dengan larutan secara umum. Larutan adalah campuran homogen yang terdiri dari dua atau lebih zat, yaitu zat pelarut (solvent) dan zat terlarut (solute). Berdasarkan kemampuannya menghantarkan arus listrik, larutan dibagi menjadi dua jenis utama, yaitu larutan elektrolit dan larutan non elektrolit.
Larutan Elektrolit
Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik karena senyawa yang terdapat di dalamnya dapat terionisasi menjadi ion-ion bermuatan listrik. Ion-ion ini dapat bergerak bebas dalam larutan, sehingga memungkinkan aliran arus listrik. Contoh larutan elektrolit meliputi asam kuat seperti HCl (asam klorida), basa kuat seperti NaOH (natrium hidroksida), dan garam seperti NaCl (natrium klorida).
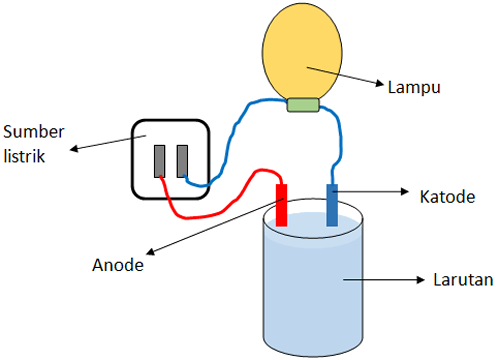
Ciri-ciri larutan elektrolit: - Dapat menghantarkan arus listrik. - Mengandung ion-ion bebas yang bergerak bebas. - Saat diuji dengan alat pengukur konduktivitas, lampu akan menyala dan terjadi gelembung gas di sekitar elektroda. - Terbagi menjadi dua jenis, yaitu elektrolit kuat dan elektrolit lemah, tergantung pada tingkat ionisasinya.
Larutan Non Elektrolit
Larutan non elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik karena senyawa yang terdapat di dalamnya tidak dapat terionisasi menjadi ion-ion. Molekul-molekul dalam larutan ini tetap utuh dan tidak membentuk ion, sehingga tidak ada aliran arus listrik. Contoh larutan non elektrolit meliputi gula (sukrosa), urea, dan etanol.
Ciri-ciri larutan non elektrolit: - Tidak dapat menghantarkan arus listrik. - Tidak mengandung ion-ion bebas. - Saat diuji dengan alat pengukur konduktivitas, lampu tidak menyala dan tidak terjadi gelembung gas. - Umumnya terdiri dari senyawa kovalen polar atau nonpolar.
Perbedaan utama antara larutan elektrolit dan non elektrolit terletak pada kemampuan mereka untuk menghantarkan arus listrik. Larutan elektrolit memiliki ion-ion bebas yang memungkinkan aliran listrik, sedangkan larutan non elektrolit tidak memiliki ion-ion bebas dan oleh karena itu tidak dapat menghantarkan arus listrik.
Jenis-Jenis Larutan Elektrolit
Larutan elektrolit dapat dibedakan menjadi dua jenis berdasarkan tingkat ionisasinya, yaitu larutan elektrolit kuat dan larutan elektrolit lemah.
Larutan Elektrolit Kuat
Larutan elektrolit kuat adalah larutan yang mengalami ionisasi sempurna saat dilarutkan dalam air. Artinya, hampir seluruh molekul senyawa terurai menjadi ion-ion bebas yang dapat bergerak bebas dalam larutan. Contoh larutan elektrolit kuat meliputi:
- Asam kuat: HCl (asam klorida), H2SO4 (asam sulfat), HNO3 (asam nitrat)
- Basa kuat: NaOH (natrium hidroksida), Ca(OH)2 (kalsium hidroksida)
- Garam: NaCl (natrium klorida), KNO3 (kalium nitrat)
Ciri-ciri larutan elektrolit kuat: - Terionisasi sempurna dalam air. - Jumlah ion dalam larutan sangat banyak. - Daya hantar listrik sangat kuat. - Persamaan reaksi ditandai dengan satu arah panah ke kanan.
Larutan Elektrolit Lemah
Larutan elektrolit lemah adalah larutan yang hanya terionisasi sebagian saat dilarutkan dalam air. Artinya, hanya sebagian kecil molekul senyawa yang terurai menjadi ion-ion bebas. Contoh larutan elektrolit lemah meliputi:
- Asam lemah: CH3COOH (asam asetat), HCN (asam sianida)
- Basa lemah: NH3 (amonia), NH4OH (amonium hidroksida)
Ciri-ciri larutan elektrolit lemah: - Terionisasi sebagian dalam air. - Jumlah ion dalam larutan relatif sedikit. - Daya hantar listrik lemah. - Persamaan reaksi ditandai dengan dua arah panah ke kanan dan ke kiri.
Manfaat Larutan Elektrolit dan Non Elektrolit dalam Kehidupan
Larutan elektrolit dan non elektrolit memiliki berbagai manfaat dalam kehidupan sehari-hari, baik dalam bidang kesehatan, industri, maupun kebutuhan rumah tangga.
Manfaat Larutan Elektrolit
- Mencegah Dehidrasi: Larutan elektrolit seperti oralit digunakan untuk menggantikan cairan dan elektrolit yang hilang akibat diare atau dehidrasi.
- Menyimpan Energi: Larutan elektrolit kuat seperti air aki digunakan dalam baterai kendaraan untuk menyimpan energi kimia.
- Bumbu Dapur: Garam (NaCl) merupakan contoh larutan elektrolit yang digunakan sebagai bumbu dapur untuk menambah rasa dan merangsang nafsu makan.
- Pengawet Alami: Asam seperti air jeruk nipis digunakan sebagai bahan pengawet alami dalam makanan dan minuman.
Manfaat Larutan Non Elektrolit
- Sumber Energi: Gula merupakan sumber energi dalam bentuk karbohidrat sederhana yang dibutuhkan tubuh.
- Pupuk Tanaman: Urea digunakan sebagai pupuk tanaman karena mengandung nitrogen yang tinggi.
- Memenuhi Kebutuhan Cairan Tubuh: Air suling digunakan untuk memenuhi kebutuhan cairan tubuh dan membersihkan alat medis.
- Bahan Baku Industri: Etanol digunakan dalam produksi kosmetik, obat-obatan, dan bahan bakar.
Cara Membedakan Larutan Elektrolit dan Non Elektrolit
Untuk membedakan larutan elektrolit dan non elektrolit, beberapa metode dapat digunakan, termasuk uji konduktivitas listrik, pengamatan visual, dan penggunaan indikator.
Uji Konduktivitas Listrik
Uji konduktivitas listrik adalah cara paling langsung untuk membedakan larutan elektrolit dan non elektrolit. Alat yang digunakan adalah konduktometer atau alat pengukur konduktivitas. Jika larutan menghantarkan arus listrik, maka larutan tersebut termasuk elektrolit. Sebaliknya, jika tidak menghantarkan arus listrik, maka larutan tersebut adalah non elektrolit.
Pengamatan Visual
Selain uji konduktivitas, pengamatan visual juga dapat digunakan. Dalam percobaan, jika larutan elektrolit dicelupkan ke dalam elektroda, lampu akan menyala dan terjadi gelembung gas. Sementara itu, larutan non elektrolit tidak akan menyebabkan lampu menyala atau terbentuknya gelembung gas.
Penggunaan Indikator
Beberapa indikator kimia seperti fenolftalein dapat digunakan untuk mengidentifikasi sifat larutan. Larutan elektrolit biasanya dapat mengubah warna indikator, sedangkan larutan non elektrolit tidak.
Kesimpulan
Larutan elektrolit dan non elektrolit memiliki perbedaan mendasar yang terletak pada kemampuan mereka untuk menghantarkan arus listrik. Larutan elektrolit mengandung ion-ion bebas yang memungkinkan aliran arus listrik, sedangkan larutan non elektrolit tidak memiliki ion-ion bebas dan oleh karena itu tidak dapat menghantarkan arus listrik. Pemahaman tentang kedua jenis larutan ini sangat penting dalam berbagai bidang, mulai dari kesehatan hingga industri. Dengan memahami perbedaan dan manfaatnya, kita dapat lebih memanfaatkan sifat-sifat unik dari kedua jenis larutan ini dalam kehidupan sehari-hari.

0Komentar